6年生文献紹介 (4)
本日の文献紹介の担当は石野くんと野村さんです。
1) 石野くん
The Parvalbumin/Somatostatin Ratio Is Increased in Pten Mutant Mice and by Human PTEN ASD Alleles
Cell Rep. (2015) 11, 944-956
文献
石野くんが解析しているノックアウトマウスも、大脳皮質における抑制性神経細胞の数が変化しているので、よく似た現象を報告している本論文を自分で探してきて、これを読んで勉強しようと思ったようです。
さて、PTEN 遺伝子ですが、もともとは”がん”との関連が報告されている遺伝子です。PTEN は PIP3 の脱リン酸化を介し PI3K-Akt 経路を抑制し、細胞の増殖・運動・細胞死を調節することが知られています。また、個体レベルで PTEN を欠損させると”がん”の発症率が上昇するので、p53 遺伝子に並ぶがん抑制遺伝子の一つとして認識されています。このようにがんとの関連が有名な PTEN ですが、今回は自閉症との関連を調べています。なぜ、著者たちは PTEN が自閉症と関連かというと、患者で PTEN 遺伝子の変異が見つかってきているからです。これまでの研究から、自閉症などを含む脳機能の異常は、大脳皮質の興奮性(Excitation)と抑制性(Inhibition)のバランス(E/I バランス)が崩れることによることで発症すると考えられています。E/I バランスがどのように維持されているのか?その分子機構の詳細は不明なのですが、興奮性神経細胞と抑制性神経細胞の割合や機能的バランス、抑制性神経細胞のサブタイプの存在比などが E/I バランスに影響を与えると考えられています。さて、先行研究では PTEN の欠損が興奮性神経細胞の過形成を起こすことを示していますが、これだけで自閉症の発症を説明するには不十分であると考えたのでしょう。著者たちは、PTEN 欠損が抑制性神経細胞に与える影響についても調べてみることにしました。PTEN 遺伝子の欠損は内側内部基底核原基(MGE)と呼ばれる部位で誕生する2種類の抑制性神経細胞(パルブアルブミン(PV)細胞、ソマトスタチン(SST)細胞)に影響を与えていました。PTEN 欠損は PV 細胞を増加させ SST 細胞を減少させるようです。その結果、PV 細胞と SST 細胞の存在比が正常値から外れます。このことが高次脳機能にどのような影響を与えているのかをγ波を測定することで推測しています。γ波は認知・記憶・意識などの高次脳機能と関連する高周波の脳波です。PTEN 欠損マウスでは、野生型マウスよりもγ波の発生頻度が増加していました。行動解析を行うと、情動行動に異常はありませんでしたが、社会性行動の低下が認められることがわかりました。以上の結果から、PTEN の欠損が PV 細胞と SST 細胞の存在比を変化させ、自閉症に関連する社会性行動の異常を引き起こすことが示唆されました。では、自閉症で見られた変異型 PTEN 遺伝子の場合はどうなるのでしょうか。自閉症に関連した PTEN 変異は PIP3 を脱リン酸化できない機能欠失型変異です。このような PTEN 変異体が抑制性神経細胞に与える影響を評価するための方法は次の通りです。PTEN 欠損の効果は細胞自律的に現れるので(周りの細胞の影響を受けないし、周りにも影響を及ぼさないので)、野生型あるいは変異型 PTEN 遺伝子を導入した MGE 細胞をマウスに移植し、この細胞を調べることで評価しています。PTEN を発現させない時と比べて、野生型 PTEN を MGE 細胞に発現させた時には、移植した細胞に対する PV 細胞の割合が減少しましたが、PTEN 変異体を導入した時は PTEN を発現させない時とほぼ変わらなかったので、PTEN 変異体は PV 細胞の割合を減少させる能力をもたないことがわかりました。この結果から、PTEN は抑制性神経細胞の PV 細胞と SST 細胞の存在比を正常に維持する役割を持っていることが示唆されました。そして、変異型 PTEN 遺伝子をもった患者は、PTEN 欠損マウスと同じようにPV 細胞と SST 細胞の存在比が崩れるため、精神機能に異常が出ている可能性が考えられました。
論文の大まかな内容は以上なのですが、幾つかの細かな点が解明されないまま残っています。そのうちの一つは、PTEN の欠損は PV 細胞を増加させるのに対し、SST 細胞は減少させるという点です。同じ前駆細胞を起源とするのに、なぜ効果が逆なのでしょうか。SST 細胞の減少はアポトーシスによると説明しています。抑制性神経前駆細胞は分化しながら大脳皮質に向かって移動していきます。早く生まれた前駆細胞は辺縁帯(MZ)を通って皮質へ移動し、遅く生まれた細胞は脳の奥深く脳室下帯(SVZ)を移動して皮質に向かいます(図1)。早生まれの SST細胞が MZ に入り皮質に移動しようとした時、PTEN を欠損していると MZ で停滞するようです(なぜ移動が停まるのかは不明)。そして、MZ を抜け出すことができなかった SST 細胞はアポトーシスを起こすため、大脳皮質の SST 細胞は減少するようです。PV 細胞が増加する理由は不明です。PTEN 遺伝子は前駆細胞の時期に欠損させておかないと影響が出ないのですが、前駆細胞の増殖には影響を与えていないという結果が示されています。なぜ、PV 細胞は増えるのでしょう?増殖ではないとすると、分化が亢進しているのでしょうか?あるいは、皮質への移動が亢進しているからなのでしょうか?また、PV 細胞に関しては、皮質における局在が変化しており、通常、IV 層に多く I 層にはほとんど存在しないのですが、PTEN を欠損させると I 層に局在するものも出てきます。この局在異常は、 MZ を通って皮質に向かって移動した早生まれの PV 細胞が MZ から皮質板へ移動しようとした時、PTEN 欠損のために移動が阻害されたために起こると考えられます (SST 細胞で見られたのと同じ現象)(図2)。
図1AIMS Neuroscience (2015) 2, 294-321
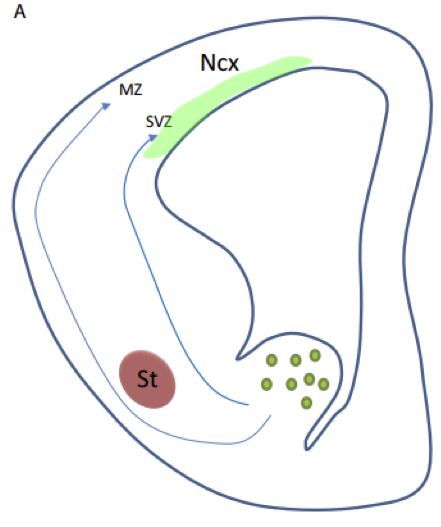 図2 Eur. J. Neurosi. (2013) 1-11
図2 Eur. J. Neurosi. (2013) 1-11

2) 野村さん
Ion exchanger in the brain: Quantitative analysis of perineuronally fixed anionic binding sites suggests diffusion barriers with ion sorting properties
Sci. Rep. (2015) 5, 16471
文献
林くんの文献紹介でも出てきましたが、今回も神経細胞の周りを囲っている細胞外マトリクス、ペリニューロナルネット (PNN)についての文献です。PNN の機能はいろいろと報告されていますが、その一つに金属イオンを保持し、それらを制御する役割があります。著者たちは、PNN を可視化し、PNN に集積する元素の種類とその局在、電荷の総量や電荷密度を定量する方法を開発しました。
新しく開発された方法を用いると、脳切片に 1.68 mM Fe イオン溶液を添加した時、PNN が保持する Fe イオンは局所的に max 65 mM であることが確認できました。一方、PNN をもたない細胞に Fe イオンはほとんど集積しませんでした。さらに、PNN に含まれるコンドロイチン硫酸をコンドロイチナーゼあるいはヒアルロニダーゼで消化すると Fe イオンの集積がほぼなくなることから、Fe イオンの集積にコンドロイチン硫酸やヒアルロン酸が関与することがわかりました。
今回開発された方法は、生理的条件下の細胞内 Fe イオンを検出できますが、PNN に集積する Fe イオンを検出することはできません。正常状態では PNN に Fe イオンはほとんど集積していないからです。したがって、生理的状態で PNN に結合している Fe イオン濃度を測定する方法というよりは、Fe イオンとの結合性を指標に PNN の能力(性質)、さらに穿って解釈すると PNN を構成するコンドロイチン硫酸やヒアルロン酸の状態を測定する方法だと考えることができると思います。今回開発した方法を用いて、いろいろな脳領域に対する Fe イオンの結合性を解析した結果、PNN がほとんど存在しない中脳は、皮質に比べて Fe イオンの結合量が低いという結果が得られました。これらの結果は、Fe イオンの結合性を指標に PNN の状態をモニターできる可能性を示しています。PNN にしっかり守られた神経細胞は酸化ストレスに抵抗性を示す、すなわち神経変性疾患に抵抗性を示すことなども報告されていますので、今回開発された方法を応用すれば、被験者が神経変性疾患に抵抗性を示す脳をもっているかどうか、抵抗性が低いので将来神経変性疾患を患う危険性が高いかどうかを判定することができるかもしれません。