Journal Club 160714
7 月 14 日の研究室セミナーにて、北澤 和之 研究員から下記の文献の紹介がありました。
Endoplasmic Reticulum Calcium Regulates Epidermal Barrier Response and Desmosomal Structure
J. Invest. Dermal. (2016) in press, doi: 10.1016/j.jid.2016.05.100.
北澤さんは皮膚について強い興味をもっています。大学院生の頃から皮膚についての研究を行ってきたので、愛着のあるテーマなのでしょう。現在もコンドロイチン硫酸が皮膚のバリア機能にどのように関わっているのかについて研究しています。
皮膚は、外界と生物個体 (私たち) を分ける境界に位置し、外界の様々な刺激から生物個体を守る砦となる器官です。皮膚にはたくさんの細胞が存在しますが、それらが一丸となって鉄壁の砦を築いています。鉄壁の砦として機能するには、細胞と細胞が隙間なく整然と並んでいることが必要です。細胞と細胞が隙間なく並ぶために”細胞接着”という現象が関与しています。細胞と細胞を接着させるための装置には幾つか種類があり、接着結合 (アドヘレンス・ジャンクション)、タイトジャンクション、接着斑 (デスモソーム) などが挙げられます。この装置の中で、接着斑 (デスモソーム) についての論文が紹介されました。
皮膚は鉄壁の砦であっても、敵があまりに強い場合、破られてしまうことがあります。この場合、何としてでも、砦を築き直さないと、敵の侵入を許してしまうことになります。本論文では、皮膚が傷付いて細胞接着が緩んだ時、どのように細胞の再接着が起こり、皮膚の構造が再構築されるのか?という問題を扱っています。
結論から言うと、皮膚が傷付いた時、細胞外のカルシウムイオン (Ca2+) 濃度が上昇し、これが緩んでしまったり、外れてしまった接着斑 (デスモソーム) を再び強く結合させるためのシグナルとして働くという内容です。この論文の新しい点は、細胞外の Ca2+ 濃度の上昇が、小胞体に蓄えられている Ca2+ が放出されることによって起こると考えている点です。また、皮膚を傷つけなくても、タプシガルジンという薬剤で、小胞体から Ca2+ の放出を誘発してやると接着斑が強固になることを示しています。このことから、著者たちは、小胞体の Ca2+ が接着斑のリモデリングを起こすマスターレギュレーターだと主張しています。
セミナーでも質問が出ていましたが、細胞外 Ca2+ 濃度の上昇のソースが小胞体の Ca2+ プールであるという点がすんなり理解できません。それは、小胞体から放出された Ca2+ が細胞外に流出する機構がわからないからです。また、細胞外に放出された Ca2+ がどのように接着斑を強めているのかについてもわかりません。疑問に思ったので調べてみました。
そもそも、小胞体の Ca2+ が接着斑を強めるために重要であることがわかったのは、角化症(ダリエー病)という病気からです。この病気は常染色体優性の遺伝性角化症で、小胞体に分布する Ca2+ ポンプ (SERCA2) をコードする ATP2A2 遺伝子が変異することで発症します。SERCA2 は細胞質から小胞体へ Ca2+ を取り込む働きをしています。SERCA2 が変異するとポンプが働かなくなるので、小胞体の Ca2+ が枯渇してしまいます。また、小胞体から細胞質に放出された Ca2+ はプロテインキナーゼ Cα の活性化を導き、これが接着斑を構成する分子を集合させるとともに、接着斑を細胞骨格に結び付けて固定するという反応を起こすそうです。このような機構で、小胞体から放出された Ca2+ は細胞接着を強めています。角化症(ダリエー病)では、SERCA2 の変異により小胞体 Ca2+ ストアが枯渇し、小胞体から Ca2+ が放出されないため接着斑の形成に異常が生じ、表皮細胞の接着不全や皮膚の角化が起こります。これは 2011 年に報告された論文の内容です。今回の報告では、小胞体から放出された Ca2+ は細胞質においてプロテインキナーゼ Cα を活性化させるだけでなく、細胞外 Ca2+濃度の上昇にも寄与することを示しています。細胞外 Ca2+濃度の上昇が、どのように接着斑を強めたり、再形成を促しているのかは不明ですが、皮膚に傷をつけた後の小胞体 Ca2+ 濃度の低下と細胞外 Ca2+ 濃度の一過的上昇が相関して起きていることを、蛍光寿命イメージング (FLIM) という方法を用いて示しています。
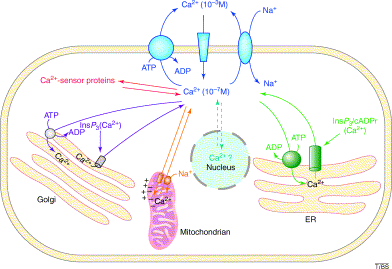
さて、小胞体の Ca2+ がどのように細胞外に流出しているかについてです。まず、細胞内 Ca2+ に関する基本事項を復習してみます。図1で示したように、細胞外 Ca2+ 濃度は 10-3 M 、細胞質 Ca2+ 濃度は 10-7 M で、細胞外に比べて細胞質では 10,000 倍も低い濃度で維持されています。 Ca2+ が細胞内に流入 (influx) する時には、細胞膜の3種類 のチャネルを使います。3種類 のチャネルは、電位依存的に開閉するチャネル, 神経伝達物質などのリガンドに依存して開閉するチャネル, 細胞内 Ca2+ ストアの状況に応じて開閉が調節されているチャネルです。 Ca2+ は必要時に細胞外から取り込む場合もありますが、一旦小胞体に貯蔵しておき、細胞内で必要とされる時に小胞体から Ca2+ を放出させて利用するという場合もあります。細胞質から小胞体への Ca2+ の取り込みはエネルギー依存的に起こります。この取り込みは上記で記した SERCA によって担われます。小胞体からの Ca2+ の放出にはイノシトール3リン酸受容体やリアノジン受容体が関与しています。
図1 細胞内 Ca2+ シグナリング(Trends in Biochemical Sciences (2004) 29, 371-379)
次に、Ca2+ の流出 (efflux) についてです。図1には示されていませんが、細胞膜には2種類の Ca2+ の流出に関わるチャネルが存在します。 Ca2+ ATPase (PMCA) と Na+/Ca2+ exchanger (NCX) です。細胞質 Ca2+ 濃度が一過的に上昇すると、PMCA や NCX を介して Ca2+ を細胞外に排出しているようです。細胞質 Ca2+ は諸刃の剣と考えられていて、細胞内の様々な反応にとって必須である代わりに、濃度が高すぎると細胞にとって強い毒性を示します。そのため、 Ca2+ 排出用のポンプが細胞膜に装備されているのでしょう。PMCA の細胞質ドメインはプロテインキナーゼA あるいは C によってリン酸化され、その活性が制御されると考えられています。上述したように、小胞体から放出された Ca2+ がプロテインキナーゼ Cα を活性化させます。この反応の下流で PMCA の活性化が起こり、 Ca2+ が細胞外へ排出される可能性が考えられます。また、NCX は細胞質ドメインが Ca2+ 濃度の上昇 (別の言い方をすると、Na+ とCa2+ の濃度差あるいは濃度勾配) を検出するセンサーとして働き、Ca2+ が結合するとポンプが活性化され、Ca2+ の排出が起こるようです。論文には記述がないのですが、おそらくこれらのポンプを介して Ca2+ は排出されているものと思われます。
最後に、細胞外に放出された Ca2+ がどのように接着斑を強めているのか?についてです。Ca2+ 濃度によってデスモソームの形成が調節されていることが in vitro で示されています。ケラチノサイト (角化細胞) を低濃度のカルシウム存在下で培養した時はデスモソームを形成しませんが、Ca2+ 濃度を上げてやるとデスモソームの形成が素早く起こり、デッシュの中で細胞が層を成して皮膚のような組織に変化するようです。これは、デスモソームを構成するデスモグレインやデスモコリンが Ca2+ 依存的にホモフィリックな二量体を形成し、細胞同士を接着させるからです。ここで、ふと思ったのですが、もともと細胞外の Ca2+ 濃度はかなり高いのに、なぜ、細胞内から Ca2+ が放出される必要があるのでしょうか?もしかしたら、全体的に濃度が高くても、デスモソームが存在する局所の Ca2+ 濃度が上がらないと、デスモグレインやデスモコリンは Ca2+ を利用できないのかもしれません。この Ca2+ の局所濃度を高めるために、細胞表面や細胞外マトリクスに存在するプロテオグリカンが働いている可能性があります。プロテオグリカンには硫酸化されたグリコサミノグリカン鎖が結合しているので、マイナスに荷電した長い鎖で、細胞内から放出された Ca2+ をすかさず絡め取って、細胞膜近傍の局所的な Ca2+ 濃度を上昇させているのかもしれません。だとすると、グリコサミノグリカン鎖も接着斑のリモデリングを起こすマスターレギュレーターだと言えるのではないでしょうか。