Journal Club 160912
夏休みも終わり、今日から教室セミナーが再開されました。
最初に、8/29 に発表できなかった5年生の井上さんの研究報告も行われました。
井上 亜里紗 コンドロイチン硫酸による皮膚の肥厚メカニズム
教室セミナーでは、シニアメンバーの Progress report (研究報告)も行われおり、今日の担当は三上先生でした。発表内容はマル秘事項です。
文献紹介
今日の文献紹介の担当は内藤先生でした。内藤先生は、プロテオグリカン (硫酸化糖鎖) による細胞質分裂の制御機構について研究しているので、細胞外マトリクス(プロテオグリカンも細胞マトリクスの一員)が接着シグナルを介して細胞質分裂のタイミングを調節するという論文を紹介しました。
Integrin signaling via FAK-Src controls cytokinetic abscission by decelerating PLK1 degradation and subsequent recruitment of CEP55 at the midbody
Oncotarget (2016) 7(21), 30820-30830
細胞が増殖する時、1つの親細胞が2つの娘細胞に分裂すると習ったと思いますが、1つの細胞がどのように2つに分かれるのか?という問題を深く掘り下げて考えてみた人は少ないと思います。天から神様の手がニューと伸びてきて、大福モチを半分に割るように、細胞を左右に引っ張って2つに分けているわけではありません。神様の手の代わりに、細胞は自分自身をくびり切るための装置をもっています。
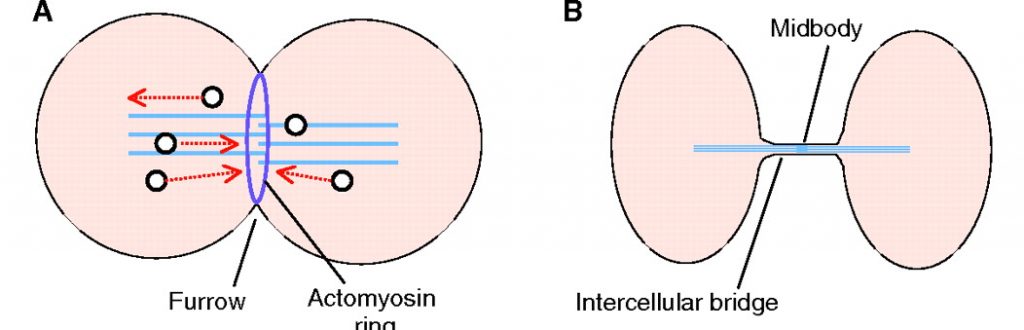
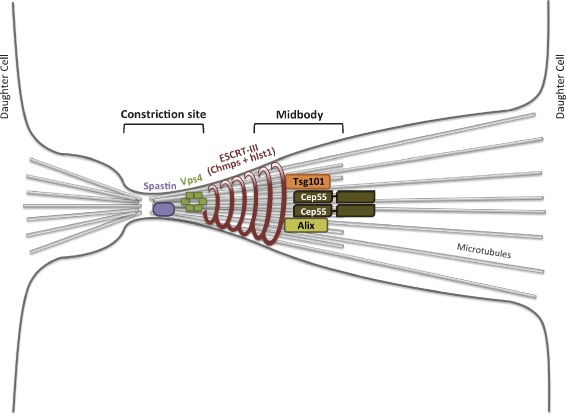
この装置は幾つもの分子から構成されていますが、普段、構成分子はバラバラの状態で存在しています。細胞分裂が始まると、細胞が割れる面に構成分子が次々と集まってきて装置が組み立てられます。その様子は合体超合金ロボが組み立てられていくようなイメージではないかと思っています。生命現象を分子生物学的に見るとメカニックなイメージとして捉えることができます。図1 の A の Furrow と書かれている部分は分裂溝と呼ばれ、アクチンとミオシンよりなるリング (収縮環)(図の紫のリング) が細胞質を絞り込むことによってできます。その後、図1 の B のように左右に引っ張られ、細くなったところの中央部に Midbody と呼ばれる構造体ができます。Midbody に細胞を2つに切断するための装置がつくられて、最終的に親細胞がくびり切れて2つの娘細胞が生じます。Midbody に存在する装置を模式的に示したものが図 2 になります。複数の分子が存在していますが(この図には示されていない分子もいます)、これらの組み立て方 (リクルートされてくる順番) には順序があります。レゴブロックを組み立てるように決まった順番で分子をくっつけていかないと完全な装置ができません。
図1 参考:J. Cell Sci. (2011) 124, 3199
図2 参考:Traffic (2011) 12, 1318
さて、今回の論文についてです。正常細胞は細胞外マトリクスに接着しないと増殖しませんが、細胞接着がどのように細胞分裂を調節しているのかについてはわかっていませんでした。本論文の細胞接着は、細胞外マトリクスとしてファイブロネクチン(FN)、細胞側の受容体としてインテグリン(ITG)、接着シグナルとして、FN-ITG-FAK-Src 経路を想定しています。FAK と Src はインテグリンの下流に位置するキナーゼで、接着シグナルが入力されると両キナーゼは活性化します。
接着条件と非接着条件 (浮遊培養) で細胞を飼うと、接着条件では図2 の装置ができるのですが、非接着条件では Alix と Tsg101 という分子が集積してきません。この原因を調べていくと、非接着条件では CEP55 が装置に集積するタイミングがズレていることがわかってきました。CEP55 は装置の中の MKLP1 という分子に結合することで装置内に取り付けられますが、この結合は CEP55 のリン酸化により調節されています。リン酸化されていない CEP55 は MKLP1 に結合しますが、リン酸化 CEP55 は結合しません。CEP55 をリン酸化する酵素は PLK1 と呼ばれるキナーゼで、その発現は FAK-Src 経路によってタンパクレベルで調節されています。PLK1 はプロテアソームで分解されるのですが、この分解をFAK-Src 経路が阻害します。接着条件では、接着シグナルによって FAK-Src 経路が活性化するので、PLK1 の分解が抑制されるため PLK1 はゆっくりと減少し、リン酸化されていない CEP55 はゆっくりと増加します。一方、非接着条件では PLK1 の分解は抑制されず、接着条件と比べてより速く減少してしまうため、リン酸化されていない CEP55 が接着条件よりも速く増加します。そのため、CEP55 の装置へ集積するタイミングがずれてしまうようです(接着シグナルありの場合に比べて集積するタイミングが早い)。このタイミングのズレのために、CEP55 に結合する Alix, Tsg101 の集積が起こらず、細胞をくびり切るための装置の組み立てが不完全になり、細胞質分裂が正常に起こらないということが明らかになりました。なお、くびり切るには図2の ESCRT-III というコイル状の分子が、そのコイル構造を利用して細胞質をギューッと締めながら切っていくのですが、 Alix, Tsg101 の集積が起こらないと ESCRT-III は集積してきません。
今回の論文から、細胞質分裂に関わる装置の組み立ては、部品を取り付ける順番が重要であるけれど、それだけでなく、たとえ順番が正しくても、部品を取り付けるタイミングがズレてしまうと次の部品の取り付けに差し障りが生じ装置が完成しないこと、そして、CEP55 という部品の取り付けのタイミングを細胞接着シグナルが調節していることが明らかになりました。ただし、CEP55 が集積するタイミングによって Alix, Tsg101 の集積が影響を受ける理由については今回の論文からは分かりません。たぶん、細胞質分裂に関わるすべての分子を、細胞周期のリズムに合わせて動かすような仕組みがあるのでしょう。だから、30~45 min の時間のズレであっても分子がすれ違ってしまうのかもしれません。待ち合わせ時間よりも早く到着してしまった CEP55 が、Alix と Tsg101 がやって来るのを「まだかな、まだかな」と待っている姿を想像するとちょっと笑ってしまいます。時間を間違えた CEP55 は Alix と Tsg101 が来るまで待っておられず帰ってしまう(装置から解離してしまう)のでしょうか?
内藤先生曰く、プロテオグリカンの中には FAK-Src 経路を調節するものも存在するので、接着シグナル経路を介して細胞質分裂を調節する可能性があるかもしれないということです。
最後に、本研究の応用面についての考察です。がん細胞は足場非依存性増殖という特徴的な性質(接着しなくても増殖する性質)をもっています。がん細胞が血管やリンパ管を通って他臓器に転移する際、浮遊状態でも生存/増殖できる性質が重要であると考えられています(足場非依存性増殖を阻害するとがんの転移が抑制される)。接着シグナルによって細胞分裂が制御される機構が明らかになれば、この制御機構のどこが破綻すると(どの分子に異常が生じると)足場非依存性増殖を獲得するのかを明らかにすることができると考えられます。したがって、著者たちの研究は、がんの転移抑制を視野にいれた基礎研究であると評価できると思います。