6年生文献紹介 (5)
本日の文献紹介担当の6年生は、尾ノ井くん、高田くん、大和田くんの3名でした。
1)尾ノ井くん
Brain-specific Crmp2 deletion leads to neuronal development deficits and behavioral impairments in mice
Nat. Commun.(2015) 7:11773, doi:10.1038/ncomms11773
生化学研究室の文献紹介では、英語の発音に慣れてもらおうという意味を込めて、発表の時、Abstract の英文を読んでもらいます。尾ノ井くんは、発音に間違いが1つもなかったと、北川先生から褒めてもらっていました。
尾ノ井くんが紹介したのは、神経系における細胞内シグナル伝達をテーマとして研究を行っている中国のグループからの報告です。彼らは、TGFβ シグナル, BMP2-SMAD シグナル, JNK シグナルなど、いろいろなシグナル伝達を幅広く扱い、これらのシグナルの神経系における機能的重要性と機能破綻によって発症する病気に興味をもって研究しています。
本論文では、CRMP2 (collapsing response mediator protein 2) と統合失調症の関連が報告されています。CRMP2 は、統合失調症患者の死後脳で発現が低下していること、CRMP2 タンパク質の変異が統合失調症のリスク要因になっていること、日本人の妄想型統合失調症発症に関連する遺伝子として知られていること、連鎖解析によるロッドスコア(ロッドスコア3以上で対象遺伝子と疾患の関連性を有意差ありとみなす)が 2~3 の間に入ってくるため suggestive な遺伝子として報告されていることなどから、統合失調症発症脆弱性因子の一つとして考えられています。
では、CRMP2 は神経細胞においてどんな働きをしているのでしょうか。このことを説明する前に、神経細胞の機能と直結する神経細胞の形態について説明します。
神経細胞の形態的な特徴は、多くの”突起”をもつことです。これらの突起は「軸索」や「樹状突起」と呼ばれていますが、この突起を介してお互いに情報を伝達することによって、記憶や運動機能の調節などの脳のはたらきを制御しています。このような突起構造は「微小管」と呼ばれる細胞骨格により形成されます。微小管はチューブリンという蛋白が多数集まって管状の構造になることによってできます。今回の論文の主役である CRMP2 はチューブリンを軸索や樹状突起に運び重合化を促進することで突起の形成を促進するタンパク質です。
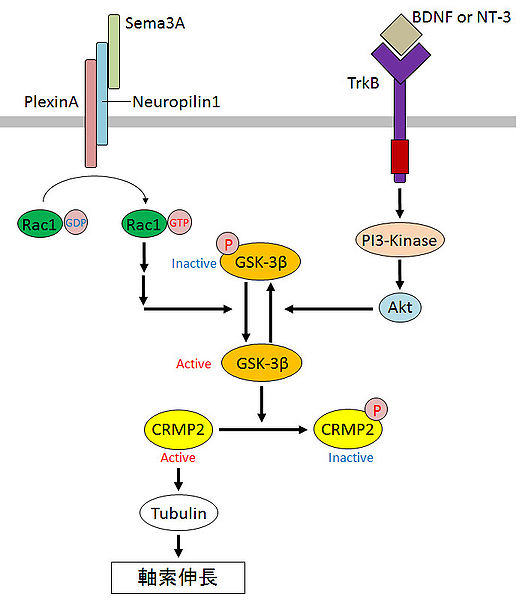
もともと、CRMP2 は神経ガイダンス因子 (神経細胞に突起を伸ばす方向を伝達する分子) であるセマフォリン (Sema) の情報を媒介する因子として同定されました。図1を見るとわかるように、CRMP2 はリン酸により活性が制御されており、リン酸化されていない CRMP2 がチューブリンの重合を促進し軸索を伸長させます。また、CRMP2 のリン酸化に関わるキナーゼ GSK-3β の活性はガイダンス因子 Sema, BDNF, NT-3 などにより調節されています。ガイダンス分子は GSK-3β などのキナーゼを介して、CRMP2 のリン酸化(活性)を制御し、神経突起の伸長を調節しています。機能と直結する突起構造の形成に関与する CRMP2 は、脳の機能に大きな影響を与えていそうです。著者たちは、このように考えて、CRMP2 を神経細胞特異的に欠損させ、個体レベルで現れる表現型を解析しようと考えたのだと思います。
CRMP2 を神経細胞特異的に欠損させたノックアウトマウス (cKO マウス) の解析結果です。CRMP2 は胎生から成獣まで脳の広い範囲で比較的高いレベルで発現していますが、CRMP2 がなくても神経系の発生過程は正常に進行し、外観上の明らかな脳の形態異常は見られませんでした。もう少し詳しく調べてみると、CRMP2 欠損により皮質の層構造や厚みには影響が出ていませんでしたが、側脳室が拡大していることがわかりました。この表現型は統合失調症の患者と同じ所見です。側脳室の拡大は一般的には灰白質(神経細胞の細胞体が存在している部位)の萎縮により起こると言われていますが、cKO では灰白質の萎縮は観察されませんでした。しかし、側脳室が拡大するということは神経細胞の数が減少しているはずなので、著者たちは神経幹細胞の増殖が低下している可能性を考えています。また、CRMP2 cKO マウスでは体重の減少が認められますが、統合失調症の患者でも同じ傾向が観察されています。
次に、CRMP2 欠損マウスに統合失調症様の症状が現れているかどうかを行動解析を行うことで調べました。cKO マウスは活動量の上昇(多動性)を示し、これは統合失調症の治療薬クロザピンによって抑制されます。著者たちは、このような多動性は統合失調症患者の精神運動性激越という状態に類似している可能性があると考察しています。さらに、統合失調症の表現型の一つとして知られているプレパルス抑制の低下が cKO マウスで認められました。他にも社会性行動の異常や海馬に依存した学習記憶能力の低下が観察されました。なお、プレパルスインヒビションとは、驚愕刺激(パルス)の直前に微弱な刺激(プレパルス)が先行することにより驚愕反応が大幅に抑制される現象です。
行動解析によって CRMP2 欠損による個体レベルの表現型がわかりましたので、次に、細胞レベルの機能 (つまりシナプス伝達) に与える影響を電気生理的な手法を用いて調べました。行動解析で海馬依存的な記憶障害を起こしていたので、海馬神経細胞について調べています。CRMP2 はシナプス後膜に局在するため、CRMP2 欠損はプレシナプス伝達にはほとんど影響を与えず、ポストシナプス伝達に影響を与えた結果、シナプス長期増強 LTP (Long-term potentiation) が著しく低下していることがわかりました。この原因を探るために、シナプス伝達に関わる NMDA 及び AMPA 受容体について調べた結果、CRMP2 欠損によりシナプス後膜における GluN1 と GluN2B サブユニットの発現レベルが低下していることがわかりました。NMDA 受容体は4つのサブユニットからなる4量体であり、サブユニットの組み合わせによりチャネルの特性や機能が異なります。GluN2B サブユニットを含む NMDA 受容体は海馬の興奮性シナプスの成熟に関与し、LTP に必要であると考えられています。また、GluN2B サブユニットを含む NMDA 受容体と CRMP2 が結合することから、NMDA 受容体の細胞内から細胞膜への輸送やシナプス後膜への trafficking が CRMP2 によって制御されているのかもしれません。CRMP2 によるこういった分子レベルの制御機構が、海馬依存的な認知や情動といった「こころ」の領域にどのように関わるのか?それは今後の研究課題です。
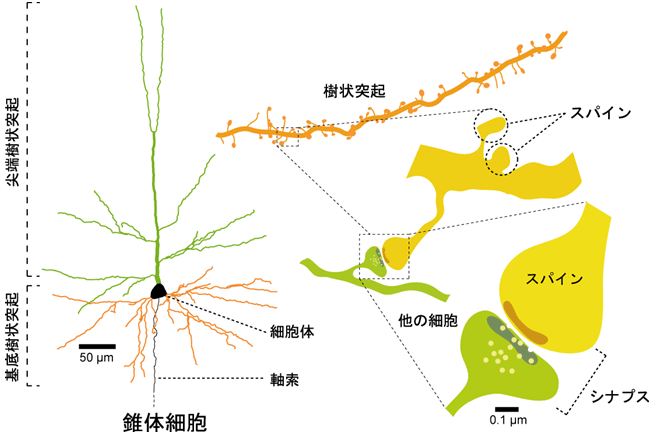
シナプスについて補足ですが、シナプス前の神経細胞の軸索終末とシナプス後の神経細胞の樹状突起との間の間隙のことで、化学伝達物質を介して信号が伝達されます。また、軸索終末は樹状突起上のスパインと呼ばれる棘状の隆起構造とシナプスを形成しています(図2)。シナプス伝達の効率は一定ではなく、入力の強度により変化し(よく使われるシナプスは増強され、使われないシナプスは衰退する)、これをシナプスの可塑性と呼んでいます。CRMP2 の欠損ではポストシナプス伝達の低下が観察されていますので、神経細胞(海馬CA1領域の錐体細胞)の形態を解析したところ、樹状突起の長さが短くなるとともに枝分かれが少なくなって、より単純な形をしていることがわかりました。また、スパインの数や1つのスパインの体積が有意に減少していました。電子顕微鏡でシナプス構造を観察したところ、CRMP2 欠損によってシナプス間隙は変化していませんが、後膜が薄くなっていることがわかりました。以上のことから、in vivo においても CRMP2 は樹状突起おいびシナプスの形成と維持に関与しており、シナプス可塑性の制御に関与する可能性が示唆されました。
図2 シナプスとスパイン (http://www.jst.go.jp/pr/announce/20090311/ より)
さて、以上の実験は、CRMP2 cKO マウスを用いていますので、受精卵として発生した時から CRMP2 が欠損しています。ところで、神経細胞の新生は発生過程だけでなく、大人の脳でも起きています。成体脳における神経新生は脳機能を正常に維持するために重要であり、神経新生の異常は神経疾患の発症に結びつくと考えられています。これらのことから、著者たちは、アダルトの神経新生における CRMP2 の機能に興味をもちました。成体脳で神経新生が起きている部位の一つに海馬の歯状回があります。レトロウイルスは新しく生まれた神経細胞に感染するので、レトロウイルスを用いることで新しく生まれた神経細胞 (海馬歯状回の顆粒細胞) に CRMP2 ノックダウンベクターを導入しました。感染させてから2週間後、CRMP2 をノックダウンしていない神経細胞(コントロール)と比較して、CRMP2 の発現をノックダウンすると、樹状突起は長く、より複雑なパターンを示し、スパインの数も多い様子が観察されました。その後、4, 6 週間と時を経るに連れ、コントロールの神経細胞の樹状突起は成長し、より複雑なパターンをとり、スパインの数も増加していきますが、CRMP2 をノックダウンした神経細胞の樹状突起は 2 週間以降はほとんど伸長せず、6 週間後には CRMP2 をノックダウンしていないコントロールの神経細胞の樹状突起より短いという結果になりました。また、スパインについても 2 週間以降、その数はほとんど変化せず、また、成熟していかないので、6 週間後の成熟スパインの数は CRMP2 ノックダウン神経細胞で有意に少ないという結果になりました。これは、cKO マウスで見られた表現型に一致します。また、海馬歯状回の神経細胞の未成熟さは、統合失調症や双極性障害の患者さんでも観察されており、これらの疾患との関連性が示されています。CRMP2 の欠損でスパインが未成熟なのは、スパインの発達異常が原因ではなく、成熟したスパインを維持できないからか、スパインの除去機構が過剰に働いているからだと著者たちは考えています。最後に、行動異常が現れたことに直結するような形態学上の表現型を解析したいと考えて、苔状線維 (mossy fiber) に注目しました。海馬の歯状回の顆粒細胞の軸索は、海馬 CA3 領域及び歯状回門に投射していますが、この軸索のことを苔状線維と呼んでいます。シナプスの樹状突起側の突起状構造はスパインと呼ばれ、軸索上の突起状構造はブトンと呼ばれています。CRMP2 をノックダウンすることによって、ブトンの体積が小さくなっている、すなわち、シナプス伝達に異常が出ていることが形態学的に示されました。CRMP2 をノックダウンした神経細胞をもつマウスに、いろいろな経験をさせた時、スパインやブトンの構造がどのように変化するのか?について、時間軸を追って解析すると、とても面白いと思います。
最後に補足情報を追加します。遺伝子の機能を個体レベルで簡単に解析できる画期的な技術として、子宮内エレクトロポレーション法という方法があります。よく利用されている方法なのですが、ノックアウトマウスの解析結果と一致しないことがあります。CRMP2 もその一例です。子宮内エレクトロポレーション法によって、胎生期に CRMP2 の発現を落とすと、発生中の神経細胞の極性や移動に異常が出ます。しかし、CRMP2 cKO マウスの脳の外観や層構造には異常がないので、矛盾を感じます。この点について著者たちは以下のように考察しています。子宮内エレクトロポレーション法は CRMP2 をノックダウンした直後の効果を見ているので CRMP2 の欠損を補う代償機構が作動する時間的余裕がないが、CRMP2 cKO マウスでは発生過程を通して十分な時間があるため、この間に代償機構が発動し CRMP2 の欠損による表現型が相殺されたのではないかと考えています。このことが正しければ、conventional なノックアウトマウスを用いた機能解析では、代償機構によって CRMP2 の重要な機能は隠されてしまい、なかなか見えてこないかもしれません。
2) 大和田くん
Adenosine Triphosphate stimulates differentiation and mineralization in human osteoblast-like Saos-2 cells
Develop. Growth Differ. (2016) 58, 400-408
大和田くんは骨代謝について研究しています。骨芽細胞を石灰化させる培養系をつくっているのですが、現在の培養条件では効率よく石灰化を起こすことができていないため、何が石灰化を制御しているのか?に興味をもったのでしょう。ATP がプリン受容体(P2X, P2Y)を介して骨化・石灰化を制御するという内容の論文を紹介してくれました。
骨は一見、石のように静的で変化のない組織に見えますが、実は、つくっては壊すというプロセスを絶えず繰り返しています。健康な骨は骨形成スピードと骨吸収スピードが等しく、動的平衡を保っています。骨形成より骨吸収が活発になると骨粗鬆症になったり、骨形成が骨吸収より多くなると骨硬化症や大理石骨病になります。骨のリモデリング(つくっては壊されるプロセス、骨代謝)がホルモン、サイトカイン、メカニカルストレスのような外的因子によって調節されることで、骨量が制御されています。ホルモンやサイトカインが骨量に影響を与えることは想像しやすいと思いますが、メカニカルストレスが骨を調節することを知らない人は多いかもしれません。そもそも、メカニカルストレスって、何?と思っている人も多いでしょう。メカニカルストレスは日本語に訳すと”力学的負荷”あるいは”機械的ストレス”という言葉で表されます。骨は重力に抵抗して身体を支える組織です。重力がかかることにより、力学的な負荷、メカニカルストレスが発生します。このような重力負荷に耐え切れずに劣化した骨は吸収され、新たな骨がつくり直されます。したがって、メカニカルストレスの強さに応じて骨のリモデリングが調節されているのは非常に理に適っていると思います。ちなみに、宇宙飛行や長期臥床のような重力がかからない状況ではメカニカルストレスは発生しないので骨形成は起こらず、骨量は減少することがわかっています。
それでは、骨はメカニカルストレスをどのように感知しているのでしょうか?、メカニカルストレスによって、どのように骨代謝が調節されるのでしょうか?非常に興味深い疑問が湧いてきます。
本論文では、2番目の問題、メカニカルストレスによる骨代謝調節機構について調べるために、培養細胞を用いた実験系を構築しようとしています。先行研究から、メカニカルストレスを感じた骨芽細胞 (骨形成を担う細胞) が ATP を大量に作り、細胞外に放出すること、放出された ATP は骨芽細胞にメカニカルストレスを伝える媒介者 (メディエーター)としての役割を担い、骨芽細胞の石灰化を誘導することが示されています。また、ATP はプリン受容体 (P2X あるいは P2Y 受容体) を介して骨芽細胞内にシグナルを入力すると考えられています。これまでの研究から、メカニカルストレスによる骨代謝調節機構に登場する分子は出揃ってきているのですが、それぞれの分子についての詳細な解析は行われていません。ATP は P2X 受容体を介して細胞内にシグナルを入力すると考えられていますが、その結果として現れる現象は実験者によりマチマチで、ATP が骨芽細胞を骨細胞へと分化させ石灰化を誘導するかどうかという問題に結論が出ていません。
そこで、著者たちは、この問題について Saos-2 細胞という骨芽細胞株を用いた実験系を使って調べることにしました。著者たちの結果によると、ATP の効果はすべての Saos-2 細胞に等価に現れるのでなく、骨細胞への分化が進行し始めた細胞、四方に突起を伸ばして星のような形態をもった骨細胞様細胞が ATP によく応答し、細胞内 Ca2+ イオン濃度を上昇させるようです。ATP に対する応答性の違いは ATP 受容体である P2X 受容体の発現が分化に伴って変化することによる可能性が考えられます。ここで、P2X 受容体について少し補足します。この受容体は細胞外の ATP により活性化されるリガンド作動性のイオンチャネルで、ATP が結合するとチャネルは開き、Na+ イオン, K+ イオン, Ca2+ イオンが非選択的に細胞内に流入します。このように語句説明のように書いてしまうと P2X 受容体のスゴさが伝わりませんよね。受容体の発見以前に思いを馳せてみましょう。細胞内のエネルギー源としての ATP の役割があまりにも有名すぎるがゆえ固定概念が出来上がってしまい、細胞外に分泌された ATP がリガンドとなって細胞表面の特異的受容体を活性化させシグナルを伝達しているなんてことは誰も想像していなかったと思います。誰かが、ATP を添加すると細胞の分化が促進するみたいだから、ATP がリガンドとなって細胞内に分化シグナルを入力していそうだと言ったとしても、一笑に付されたのではないでしょうか。このことが現実味を帯びてきたのは、ATP の受容体である P2X あるいは P2Y 受容体が発見されてからです。受容体の発見により、ATP の驚くべき作用が次々と明らかにされていったわけなので、かなりセンセーショナルな大発見だったのではないでしょうか。研究に携わっている人は誰しも、こういった概念を塗り替えるような発見をしてみたいと願いつつ、毎日の地道な実験を繰り返しているんです。話が逸れてしまいましたが、P2X 受容体が活性化された結果、膜電位の変化や細胞内 Ca 濃度の変化を引き起こします。また、P2X 受容体にはサブタイプが存在し、P2X7 以外は 1〜10 uM の細胞外 ATP によって活性化されますが、P2X7 受容体の活性化には非常に高濃度の細胞外 ATP (0.1 〜 1 mM) が必要となります(P2X7 受容体の真のリガンドは ATP ではなく、ATP4- だからだそうです)。著者たちの実験では 1 mM ATP で Saos-2 細胞を刺激していますが、高濃度の ATP を用いるのはこういう事情があるのでしょう。なお、P2X7 受容体は骨に関わる ATP 受容体として機能的に注目されています。なぜなら、 P2X7 遺伝子ノックアウトマウスの解析から、P2X7 受容体が膜性骨化におけるメカニカルストレスの伝達に必要であること、骨吸収が高まっている閉経後の女性で P2X7 の活性が低下していることからです。
本論文を読むと、骨への分化過程や石灰化における ATP の効果をできるだけ単純に解析するために、細胞レベルに還元した実験系をつくったものの、依然としてややこしいやん!という印象をもちます。骨芽細胞から骨細胞へと分化する際、8段階のステージをステップアップするモデルが提唱されています。たとえ均一な細胞集団からスタートしても、分化誘導をかけると、性質の違う細胞が混じった状態になる上、各分化ステージにある細胞の割合が刻々と変化するようです。したがって、ATP を添加する時期と ATP 濃度をきっちりとコントロールしなければ、再現性のある結果が得られないのでしょう。このような不均一系を解析するのに、サンプルをすり潰し、集団を構成する細胞の平均値を解析するような生化学的な手法は向いておらず、もっと別のアプローチをとるべきなのかもしれません。
この論文をもとに分化誘導条件を改良し、大和田くんの細胞が迅速にそして明瞭に石灰化を起こすようになるといいですね。ATP が大和田くんの実験の”魔法の粉”になりますように。。。
3) 高田くん
E-cadherin is important for cell differentiation during osteoclastogenesis
Bone (2016) 86, 106-118
大和田くんが骨芽細胞による骨形成、高田くんは破骨細胞による骨吸収を研究していて、二人合わせて骨のリモデリングを研究しています。
大和田くんの項でも書きましたが、骨は絶えず新陳代謝を繰り返しています。
なぜ骨はつくられては壊されなければならないのでしょうか?
この問いかけの答えを書く前に、骨についての基本的な情報を記します。
骨はカチカチのカルシウムの塊のように見えますが、カルシウムだけではなく、コラーゲンというタンパク質を大量に含んでいます。コラーゲンの骨組みに、カルシウムをコンクリートのように塗り込んでつくったビルが骨というわけです。そして、このビルには骨細胞が住んでいて、骨細胞に栄養や酸素を供給する血管も発達しています。
さて、問いかけの答えの”その1”です。骨が壊されなければならないのは、骨にはカルシウムの貯蔵庫としての役割があるからです。骨を溶かしてカルシウムを放出することで、血中のカルシウム濃度を維持しているからです。
もう一つの答えです。骨の骨組みを作っているのはコラーゲンであるので、古くなると弾力を失ってきます。骨が脆くなると体を支えられなくなるので、老朽化した骨は壊して作り直すことで強い骨を維持しています。
こういった事情があり、骨は壊されなければならないのです。では、誰が骨を壊すのかというと、それは破骨細胞です。破骨細胞は、骨をたたき壊したり、食べたりしてるわけではなく、分解酵素を分泌することで骨を溶かしています。破骨細胞は骨を溶かす酵素をつくれるようになったら一人前というわけです。破骨細胞はもともとは血球系の細胞(単球あるいはマクロファージ系の細胞)です。上記で、骨には多数の血管が入り込んでいるということを書いたと思いますが、破骨細胞のもととなる細胞は血中から骨へ入ってきて、破骨細胞へと分化していきます。したがって、血球系の細胞が破骨細胞に分化してくれないと骨吸収がうまくいかないので、血中カルシウム濃度が維持されなかったり、老朽化した骨がリフォームされないので、ボロボロの体になってしまいます。そうならないために、血球系の細胞がどのように破骨細胞に分化していくのか?、破骨細胞の分化機構を詳細に調べる必要があります。
さて、破骨細胞の分化ですが、特徴的なのは細胞融合が起こるということです。最初に血球系の細胞同士がピタッとくっついて、その後、2つの細胞の細胞膜の融合が起こり1つの細胞になります。2つの細胞が1つになるので、融合後の細胞の核は2つになります。融合してできた細胞に、さらに別の細胞が接着し融合するので、核の数が増えるとともに巨大な細胞になっていきます。こうしてできた細胞が破骨細胞です。
本論文では、分化の最初の過程、2つの細胞がくっつく細胞間接着の過程に注目しています。
細胞同士がくっつくために、カドヘリンという接着分子が働いています。カドヘリンという分子は竹市雅俊先生によって発見されました。この発見により何度も何度もノーベル賞の候補者としてノミネートされています。竹市先生は、今は亡き岡田節人(ときんど)先生の秘蔵っ子です。節人先生は発生生物学の分野で超有名な先生ですが、代表作はイモリの目のレンズを取り除くと、ひとみの上側の黒い色素細胞が変化してレンズに変わる分化転換の現象を見つけた研究です。分化転換以外のもう一つのテーマとして、節人先生は、細胞を識別し似た者同士が接着する仕組みを解明したかったそうです。このテーマは、文学青年であった節人先生が、ゲーテの『親和力』やホルトフレーターの「形態形成の基本的原理としての組織親和力」という論文に出会ってひらめいたそうです。その後、この興味深いテーマは、節人研究室で研究を始めた竹市先生に受け継がれ、カドヘリンの発見へと至りました。何が細胞の種類を見分けているのか?という問題の答えがカドヘリンという分子だったのです。カドヘリンには幾つかの種類があって、同じカドヘリン同士なら結合するけれど、種類の違うカドヘリン同士だと結合しません。同じ種類の細胞同士がくっつくという現象は、分子レベルで言い直すと、同じ種類のカドヘリン同士が結合するということになります。このような結合の仕方を「ホモフィリックな結合(相互作用)」と言います。
論文の内容に戻りましょう。破骨細胞のもとになる血球系の細胞は E-カドヘリンを発現しています。接頭語の E についての補足説明ですが、E-カドヘリンはもともと上皮系の細胞から見つかったので、上皮細胞を示す Epitherial の頭文字をとって E-カドヘリンと名付けされています。著者たちは、E-カドヘリンが分化前の細胞同士の接着やその後の融合に関わるのか?について調べることにしました。
こういった問題を調べるには、対象分子を増やした時、あるいは対象分子のはたらきを抑制した時に調べたい現象はどうなるかを見るのが常套手段となっています。著者たちも、E-カドヘリンを過剰発現させた場合や E-カドヘリンの抗体を用いて E-カドヘリンの機能をブロックした場合、破骨細胞への分化がどうなるのかについて調べています。この実験を行う前に、E-カドヘリンの発現について調べたところ、分化初期、つまり細胞同士が接着する時期に発現レベルが最も高くなり、しかもE-カドヘリンが細胞表面に存在することがわかりました。著者たちの予想通り、E-カドヘリンは血球系細胞が破骨細胞へ分化する初期の細胞の接着過程で何かをしていそうです。そこで、E-カドヘリンの抗体を用いて、E-カドヘリンのホモフィリックな結合を阻害すると(つまり、細胞間接着を阻害すると)、破骨細胞への分化が遅れることがわかりました。逆に、E-カドヘリンの発現を上げてやると期待通りに破骨細胞への分化が早まりました。また、著者たちは興味深い2つの現象を見つけています。一つは、カドヘリンによる細胞間接着が起きると、NFATc1 と呼ばれる転写因子が核へ移行するという現象です。NFATc1 は破骨細胞の分化に必須の転写因子で、リン酸化の状態によって細胞内の存在場所が変化します。転写は核で行われますが、NFATc1 はリン酸化されている状態では核外にあり、脱リン酸化されて核内へ移行し、転写を行うことができるようになります。核へ移行した NFATc1 が、血球系細胞を破骨細胞へと分化させるために必要な遺伝子の発現を誘導します。また、NFATc1 のリン酸化状態を制御するホスファターゼはカルシニューリンであることがわかっています。しかし、なぜ、E-カドヘリンによる細胞接着によって NFATc1 のリン酸化状態が変化するのか?、E-カドヘリンによる細胞間接着によってカルシニューリンの活性が制御されるのか?については不明です。もう一つの興味深い現象は、E-カドヘリンにより細胞の運動が活発になるということです。細胞が動く時には、アメーバーが仮足を伸ばすように、ラメリポディア (葉状仮足) と呼ばれる足をニューっと伸ばします。あっちの細胞とこっちの細胞から伸びた足が絡み合って融合が起き始めるような像が見えているそうです。著者たちは、E-カドヘリンが関連する細胞運動が細胞融合に重要であると考えていますが、E-カドヘリンがラメリポディアの形成にどう関わって、細胞の運動や極性を調節するのかについては今後さらなる研究が必要とされます。分化誘導前の血球系細胞も E-カドヘリンを比較的高いレベルで発現しているようなのですが、分化の刺激を受けなければ細胞間接着は起こらないし、細胞融合は始まりません。このことから、E-カドヘリンを調節する機構、つまり破骨細胞への分化を指示するスイッチをオンにする機構が E-カドヘリンの上流に存在する可能性が考えられます。